
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. Задача 1.Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л
Задача 1. Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л, а k=1,5∙10-3л∙моль-1∙с-1.
Решение:
AgNO3 + KCl = AgCl↓ + KNO3
Скорость прямой реакции равна:
υ = k·[AgNO3]·[KCl]
υ = 1,5∙10-3 · 0,2 · 0,3 = 9·10-5 моль/л·с
Таким образом, скорость реакции равна v = 9·10-5 моль/л·с
Задача 2. Рассчитайте, во сколько раз изменится скорость реакции Н2+Сl2 = 2НСl при увеличении давления в 2 раза.
Решение:
В реакции:
H2 + Cl2 = 2HCl
υ 1 = k∙[H2]∙[Cl2];
При увеличении давления в 2 раза концентрация веществ увеличится тоже в 2 раза, и скорость реакции станет равна:
υ 2= k∙[2H2]∙[2Cl2]
υ2/υ1= k∙[2H2]∙[2Cl2]/k∙[H2] ∙[Cl2] = 4.
Тогда скорость реакции возрастает в 4 раза.
Задача 3. Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при нагревании реакционной смеси от 30 °С до 50 °С?
Решение:
Воспользуемся правилом Вант-Гоффа:
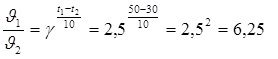
Скорость реакции увеличится в 6,25 раз
Задача 4. При установившемся равновесии в реакции Fe2O3(т)+ 3CO(г) = 2Fe(т) +3CO2(г), равновесные концентрации составили: [CO]=1 моль/л и [CO2]= 2 моль/л. Вычислите исходную концентрацию [CO]исх. Чему равна константа равновесия?
Решение:
Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г)
3 моль СО2 образуется, если в реакцию вступают 3 моль СО,
2 моль СО2 — х
х = 2 моль СО
Значит исходная концентрация [CO]исх = [CO]pавн + 2 моль =1+2=3 моль.
К = [СО2]3 ̸ [СО]3
К = 23/13 = 8
Задача 5. Для реакции FeO(к) + CO(г) ↔ Fe(к) + CO2(г) константа равновесия при 10000С равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль/л. Найдите их равновесные концентрации.
Решение:
FeO(к) + CO(г)↔Fe(к) + CO2(г)
Запишем выражение для константы равновесия:
К = [СО2] ̸ [СО]
Пусть равновесные концентрации равны:
[СО]равн = (0,05 – х) моль/л
[СО2]равн = (0,01 + х) моль/л
Подставим значения в выражение для константы равновесия:
К = (0,01 + х)/(0,05 – х) = 0,5
Решая уравнение, найдем х:
х = 0,01
[СО]равн = 0,05 – 0,01 = 0,04 моль/л
[СО2]равн = 0,01 + 0,01 = 0,02 моль/л
Задача 5. Как повлияет на смещение равновесия в системе
4HCl(г) +O2(г) ↔2Cl2(г) +2H2О(ж); ΔН0298 =−202,4кДж: а) повышение температуры; b) уменьшение общего объема смеси; c) уменьшение концентрации кислорода; d) введение катализатора?
Решение:
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔН0298 =−202,4кДж
ΔН0298 ˂ 0, следовательно, реакция экзотермическая, поэтому, согласно принципу Ле-Шателье, при повышении температуры равновесие сместится в сторону образования исходных веществ -влево.
При уменьшении давления, равновесие смещается в сторону реакции, идущей с увеличением числа молекул газообразных веществ. В данном случае в равновесие смещается сторону образования исходных веществ - влево.
Уменьшение концентрации кислорода как исходног вещества также будет способствовать смещению равновесия влево и уменьшению выхода хлора.
Внесение катализатора в систему приводит к увеличению скорости как прямой, так и обратной реакций. При этом, изменяется скорость достижения состояния равновесия, но при этом константа равновесия не меняется и смещения равновесия не происходит.
Не нашли, что искали? Воспользуйтесь поиском: